PD Dr. Tim Zimmermann
1. Medizinische Klinik und Poliklinik, Universitätsmedizin Mainz
Bei der familiären Amyloid-Polyneuropathie (FAP) handelt es sich um eine seltene, vererbte genetische Erkrankung. Durch eine Mutation im Transthyretin (TTR)-Gen wird ein fehlerhaftes Eiweiß produziert, was zu einer abnormen Ablagerung dieses Proteins im Nervensystem und in Organen führt.
Insgesamt sind über 130 verschiedene Mutationen beschrieben [1]. Am häufigsten findet sich die Val30Met-Mutation. Die betroffenen Patienten erleiden meist in einem mittleren Alter von 35 Jahren typische Symptome der Nervenschädigung (Polyneuropathie, PNP) mit Missempfindungen und Störungen im Bereich der Extremitäten und des vegetativen Nervensystems, u.a. im Magen-Darm-Trakt. Im fortgeschrittenen Stadium können Symptome wie Taubheitsgefühl, Muskelschwäche, Inkontinenz, Gewichtsverlust, Kreislauf- und Herzrhythmusstörungen auftreten [2]. Die unterschiedlichen Mutationen können im Hinblick auf die Organmanifestation und den Schweregrad der klinischen Symptomatik stark variieren. Die Val30Met-Mutation führt zu einem überwiegenden Befall des Nervensystems. Andere Mutationen sind z.B. mit kardialen oder anderen Organmanifestationen assoziiert.
Seit 5 Jahren gibt es mit Tafamidis (Vyndaqel®) eine zugelassene medikamentöse Behandlungsoption, die verhindern soll, dass sich das fehlerhafte Protein ablagert. Durch die Therapie kann das Voranschreiten der Nervenschädigung verzögert werden [3]. Auf Dauer ist die Lebertransplantation (Ltx), im Sinne einer Gentherapie, die derzeit einzige und beste Möglichkeit der Behandlung einer FAP, da das fehlerhafte Transthyretin zu über 95 Prozent in der Leber gebildet wird [4].
Patienten mit FAP können auf die Warteliste zur Ltx aufgenommen werden und Zusatzpunkte (exceptional MELD) erhalten, wenn die Mutation im TTR-Gen mittels DNA-Analyse oder Massenspektrometrie gesichert ist und Amyloidablagerungen in einem Organ mittels Biopsie nachgewiesen werden (Richtlinie für die Wartelistenführung und Organvermittlung zur Lebertransplantation; Deutsches Ärzteblatt, DOI: 10.3238/arztebl.2016.rili_baek_OrgaWlOvLeberTx20161028).
Gemäß den aktuellen Richtlinien der Bundesärztekammer sollte die FAP-Leber, wenn möglich, zur Domino-Ltx verwendet werden (Abb. 1). Dabei wird der FAP-Patient mit einer postmortalen oder Lebend-Spende transplantiert. Seine eigene (FAP-)Leber wird weiter gespendet. Dieses Verfahren wurde erstmals 1990 durchgeführt und wird mittlerweile routinemäßig praktiziert [5,6]. Bis Ende 2013 wurden 1.112 Domino-Leber-Transplantationen in einem weltweiten Register dokumentiert (www.fapwtr.org). Der Spenderpool wird durch diese Organe erweitert. Die Ergebnisse einer Domino-Spende sind exzellent und mit denen einer Nicht-Domino-Spende vergleichbar. Eine Vererbung der Erkrankung durch den Empfänger eines FAP-Organs ist nicht möglich.
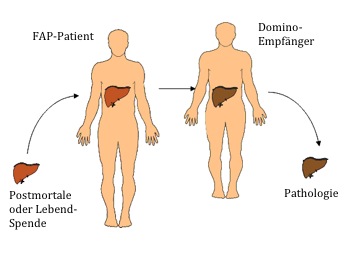
Ein großer Vorteil der Domino-Transplantation ist, dass es sich um junge Spenderorgane mit normaler Funktion handelt. Als Nachteil ist anzumerken, dass der Gendefekt dem Empfänger mittransplantiert wird, so dass es auch bei ihm auf Dauer zu Ablagerungen im Nervensystem und in Organen kommen kann. Früher ging man davon aus, dass eine FAP frühestens nach 18 Jahren auftritt [7,8]. Daher wurden diese Organe bevorzugt für Empfänger mit höherem Lebensalter verwendet. Mittlerweile existiert eine Reihe von Fallberichten, in denen das Auftreten einer sog. de novo-Amyloidose innerhalb von 10 Jahren nach Ltx beschrieben wird [9-11].
Eine de novo-Amyloidose beim Empfänger manifestiert sich in der Regel wie bei FAP-Patienten mit den o.g. Symptomen. Die Diagnose ist nach Transplantation häufig durch Comorbiditäten, wie z.B. eine vorbestehende Alkohol-, Diabetes- oder Calcineurininhibitor-assoziierte PNP erschwert. Der Zeitpunkt des Auftretens einer de novo-Amyloidose ist nicht vorhersehbar und variiert stark. Insgesamt scheinen nur wenige Empfänger eine frühe Krankheitsmanifestation der FAP innerhalb von 10 Jahren nach Ltx zu erleiden. In einer französischen Kohorte entwickelten 7 von 114 Patienten eine de novo-Amyloidose [12]. Amyloidablagerungen wurden bei 3 Patienten in der Nervenbiopsie nachgewiesen [12]. In einer weiteren Kohorte trat bei einem von 106 Patienten eine gesicherte de novo-Amyloidose 8 Jahre nach Ltx auf [13]. In unserer eigenen Erfahrung erlitten zwei von 25 Patienten eine de novo-Amyloidose, wovon einer 12 Jahre nach Ltx retransplantiert werden musste. Regelmäßige neurologische und kardiologische Verlaufskontrollen nach Ltx sind erforderlich. Bisher existieren keine Daten, ob Tafamidis oder neuere Therapieformen bei de novo-Amyloidose nach Ltx wirksam sind. Ultima ratio ist die Retransplantation.
Da FAP-Lebern voll funktionstüchtig sind und von jungen Spendern stammen, können sie prinzipiell für alle Grunderkrankungen verwendet werden. Profitieren können schwerstkranke Patienten mit niedrigen MELD-Werten, die mit hoher Wahrscheinlichkeit nicht rechtzeitig ein Organangebot bekommen. Die häufigste Indikation ist das Hepatozelluläre Karzinom (HCC) [14]; The Domino Liver Transplant Registry, www.fapwtr.org.
Bei der Auswahl eines geeigneten Domino-Empfängers sollten eine Reihe von Faktoren berücksichtigt werden. Neben allgemeinen Parametern, wie der Größe, Blutgruppe, Grunderkrankung und Dringlichkeit, sollten das Empfänger-Alter, vorbestehende Comorbiditäten, wie z.B. eine diabetische PNP, sowie die unterschiedlichen TTR-Mutationen in Verbindung mit dem individuellen Risikoprofil beachtet werden. Während Organe mit einer Val30Met-Mutation für Patienten mit einer vorbestehenden PNP anderer Genese ungeeignet scheinen, sollte eine Ala60-Mutation, die mit einer kardialen Manifestation der Amyloidose assoziiert ist, für Patienten mit einer vorbestehenden Herzerkrankung kritisch betrachtet werden [15].
Bisher wurden aufgrund des längerfristigen Risikos der Entwicklung einer de novo-Amyloidose überwiegend ältere Patienten mit FAP-Organen versorgt [14]. Nach neueren Daten scheint jedoch die Entwicklung einer de novo-Amyloidose im Alter schneller voranzuschreiten [16]. Risikofaktoren für die Entwicklung einer frühen Manifestation sind bis dato unbekannt. Empfänger müssen über das mögliche Auftreten einer de novo-Amyloidose nach Ltx aufgeklärt werden.
Für schwerstkranke Patienten mit stark reduzierter Lebenserwartung, die aufgrund eines niedrigen MELD-Scores und des bestehenden Spendermangels mit hoher Wahrscheinlichkeit kein Organangebot erhalten, ist eine Domino-LTx eine sehr gute Option mit einem überschaubaren Risiko für die Entwicklung einer de novo-Amyloidose. Die Auswahl eines optimalen Empfängers sollte aufgrund der Komplexität der Erkrankungen des Spenders und Empfängers und unter Berücksichtigung individueller Faktoren durch ein erfahrenes interdisziplinäres Team in der Transplantationskonferenz besprochen werden. In Zukunft sollten anhand der weltweiten Transplantationsregister Selektionskriterien für Domino-Empfänger etabliert werden.
Literatur
Lebertransplantierte Deutschland e.V.
Montag - Freitag 9:00 bis 13:00 Uhr
Telefon: 02302/1798991
Fax: 02302/1798992
Sie möchten Mitglied werden?
Hier gehts zur Beitrittserklärung
Sie möchten unsere Arbeit unterstützen?
Hier können Sie spenden