Dr. med. Julia Kälsch
Prof. Dr. med. Ali Canbay
Prof. Dr. med. Guido Gerken
Klinik für Gastroenterologie und Hepatologie, Universitätsklinikum Essen
Die Leber beansprucht als größtes Stoffwechselorgan etwa ein Viertel des Herzzeitvolumens. Als einzige beiden Organe des menschlichen Körpers werden Leber und Herz von zwei Kreislaufsystemen versorgt. Die Leber erhält ungefähr 75% des Blutflusses über die V. portae und 25% über die A. hepatica [1]. Sowohl Zucker(Glucose)- als auch Fett(Lipid)- und Eiweißmetabolismus bzw. Speicherung werden hepatisch reguliert. Eine Störung dieser Stoffwechselwege trägt im Langzeitverlauf zum Risiko für eine Herz-Kreislauf-Erkrankung bei. Eine Störung der Durchblutung der Leber, wie sie im Rahmen einer schweren Herzinsuffizienz auftreten kann, führt zur Leberschädigung oder sogar –versagen.
Erkrankungen von Leber und Herz können zur Beeinträchtigung bzw. Schädigung des jeweils anderen Organs führen. Eine akute Hepatopathie, wie z.B. eine akute Virushepatitis, kann zur Veränderung kardialer Laborparameter wie Troponin I oder BNP als Ausdruck einer kardialen Beteiligung führen. Die sich über Jahre entwickelnde Leberzirrhose kann zu einer bestimmten Form der Herzinsuffizienz, der zirrhotischen Kardiomyopathie führen. Diese Verdachtsdiagnose kann gestellt werden bei jeder neu aufgetretenen kardialen Dysfunktion bei Patienten mit Leberzirrhose, für die sich unabhängig davon keine andere kausale Erklärung findet. Häufig wird diese Herzerkrankung erst klinisch offensichtlich, wenn sich das Herz-Kreislauf-System Stressbedingungen anpassen muss (z.B. einer Operation oder einer intensivmedizinischen Komplextherapie) [2]. Eine Studie zeigt, dass bei Patienten, die an einer Leberzirrhose versterben, in ca. 7 bis 20% auch eine Herzinsuffizienz vorlag [3]. Daten aus dem Transplantationszentrum Essen zeigen, dass ein akutes Leberversagen auf dem Boden einer Herzinsuffizienz mit einer besonders hohen Mortalität assoziiert ist [4].
Ist das Herz zuerst erkrankt, folgt häufig eine Funktionseinschränkung oder sogar eine bleibende Schädigung der Leber. Eine akute Herzinsuffizienz kann zu einer schwerwiegenden Minderdurchblutung der Leber führen, der sogenannten hypoxischen Hepatitis. Liegt eine chronische Herzinsuffizienz vor, kommt es zu einer Stauung der Leber. Das Blut wird nicht ausreichend abtransportiert und der zentralvenöse Druck steigt. Im Verlauf zeigen sich histologisch strukturelle Veränderungen der Leber. Das Lebergewebe verfettet als Folge der unzureichenden Durchblutung. Aus den kleinen Lebervenen tritt Blut in das umgebende Gewebe aus, da der Abfluss nicht ausreichend ist. Der Pathologe bezeichnet diese Veränderungen des Lebergewebes bildlich als „Muskatnuss-Leber“ [5]. Im Langzeitverlauf können diese Veränderungen sogar zu einer Leberfibrose bzw. –zirrhose führen [6, 7].
m Jahre 2008 wurde erstmalig festgehalten, dass die nicht-alkoholische Fettlebererkrankung (NAFLD) die Manifestation des metabolischen Syndroms in der Leber darstellt [8]. Die NAFLD ist die häufigste chronische Lebererkrankung und betrifft 15-39% der Europäer [9]. Die NALFD stellt sich klinisch nicht nur als „simple“ Leberverfettung dar, sondern auch als chronische und aggressive Form mit mikroskopisch deutlichen Veränderungen der Leberzellen im Sinne von Verfettung, Entzündung und einem „Anschwellen“ der Leberzellen, mit oder ohne Fibrose. Diese Form der NAFLD bezeichnet man als nicht-alkoholische Steatohepatitis (NASH) [10, 11]. Bei den meisten chronischen Lebererkrankungen ist eine langsame Progression über Fibrose und Zirrhose hin zur Tumorentwicklung zu beobachten. In den letzten Jahren mehren sich jedoch die Berichte über Lebertumore bei NAFLD-Patienten, die keine Leberzirrhose aufweisen. Tatsächlich liegt der Anteil an zirrhotischen Patienten mit einem NAFLD-induzierten Leberzellkarzinom bei unter 50%, während er bei anderen chronischen Lebererkrankungen zwischen 70 und 99% liegt [12].
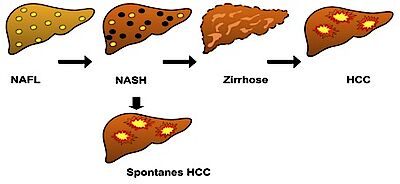
Durch die intrahepatische Fettansammlung kommt es über mehrere Mechanismen zur Aktivierung von Entzündungszellen mit anschließendem Zelluntergang. Eine Unterscheidung zwischen einfacher Verfettung, der Steatose (NAFL) und NASH ist bislang sicher nur durch eine Leberbiospie und histologische Bewertung des Gewebes möglich. Klassische Blutwerte der Leberschädigung (Transaminasen, gamma-GT) werden jedoch oft herangezogen, um den Schweregrad einer NAFLD abzuschätzen.
Eine nicht-invasive Bestimmung der NAFLD wird zusätzlich dadurch erschwert, dass klassische Leberparameter (ALT/GPT, AST/GOT) oftmals nicht über die aktuellen Normwerte erhöht sind. Möglicherweise sind die üblichen Grenzwerte zur Einschätzung der NAFLD zu hoch gesetzt [13]
Neue molekulare Marker könnten hier Abhilfe schaffen, zu denen der spezifische Apoptose-Marker M30 (ein Caspase-gespaltenes Zytokeratin-18-Fragment) gehört und seit einigen Jahren vielversprechende Ergebnisse liefert [14-16], jedoch nicht ausschließlich für die NAFLD spezifisch zu sein scheint [17, 18].
Eine Kombination verschiedener Marker bietet vermutlich die größten Erfolgsaussichten, einen verlässlichen „Score“ zur Bestimmung der NAFLD-Schwere zu erstellen [19]. Auch eine Unterscheidung von primär alkoholischer Leberschädigung (ASH) und NAFL bei Patienten mit ähnlichem BMI ist grundsätzlich mit nicht-invasiven Parametern möglich [20].
Aufgrund der Tatsache, dass die Leber als zentrales Organ des Metabolismus, insbesondere des Glucose- und Lipidstoffwechsels, eine wichtige Rolle spielt, geht man davon aus, dass die Leber einen Einfluss auf das Herz-Kreislauf-System hat.
Die NAFLD, insbesondere die NASH, kann zur Entstehung der koronaren Herzerkrankung (KHK) beitragen durch die Freisetzung von gefäßschädigenden Mediatoren durch die steatotische und inflammatorische Leber; weiterhin leistet sie einen Beitrag zur Insulin-Resistenz und Fettstoffwechselstörung als wichtige Risikofaktoren für kardiovaskuläre Erkrankungen [21]. Kürzlich wurde die NAFLD sogar als ein vom metabolischen Syndrom unabhängiger Risikofaktor für die Atherosklerose bei männlichen Erwachsenen beschrieben [22].
An den Folgen eines Herzversagens versterben viele Patienten im Rahmen einer Lebertransplantation peri- oder postoperativ trotz erfolgreicher Operation und sehr guter Organqualität [23].
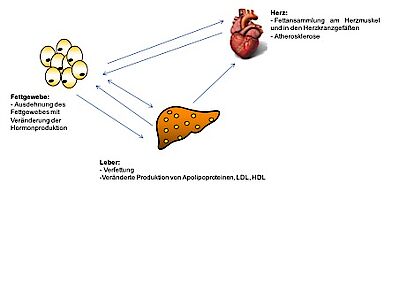
Zusammenfassend ergibt sich im Hinblick auf die multiplen Interaktionen zwischen Leber und Herz, dass im Falle einer Erkrankung eines dieser beiden Organe immer beide Organsysteme im Zentrum der Diagnostik stehen sollten.
Lebertransplantierte Deutschland e.V.
Montag - Freitag 9:00 bis 13:00 Uhr
Telefon: 02302/1798991
Fax: 02302/1798992
Sie möchten Mitglied werden?
Hier gehts zur Beitrittserklärung
Sie möchten unsere Arbeit unterstützen?
Hier können Sie spenden